「ドライアイ」という言葉から、「目が乾いて涙が足りない状態」を想像されるかと思います。
しかし、現代の眼科医学における知見は、「ドライアイ」の一般的なイメージを大きく覆すものです。
驚くべきことに、
ドライアイと診断される患者さんの約8割は、実は涙の量が正常、あるいはむしろ多い状態なのです。
涙があふれているのに「ドライアイ」と診断される—この一見矛盾した現象は、「蒸発亢進型ドライアイ(Evaporative Dry Eye)」と呼ばれる病態に起因します。
「蒸発亢進型ドライアイ(Evaporative Dry Eye)」:問題の本質は「涙の量」ではなく「涙の質」にあります。
まぶたの縁に並ぶマイボーム腺という小さな脂腺の機能不全が根本原因となり、涙が過剰に蒸発することで様々な眼不快感が生じます。
ドライアイの概念は2019年に大きくパラダイムシフト※して、現在では「涙液層の不安定性」が診断の中心となりました。
「どれだけ涙があるか」ではなく「涙が目の表面でどれだけ安定しているか」が重要です。
従来の「涙を増やす」治療から「涙の質を改善する」治療へ、方向性は大きく変化しています1。
※パラダイムシフト:従来の考え方や概念の枠組みが、根本的かつ革命的に変化すること。
ここでは、ドライアイを「涙が少ない状態」と考える従来の概念から、「涙液層の安定性の問題」という新しい理解への転換を指します。
現代眼科医学における「乾かないドライアイ」の真実と、マイボーム腺ケアを中心とした現在の治療アプローチについて、科学的根拠に基づいて解説します。
目の不快感でお困りの方が、適切な理解と対処法を見つける一助となれば幸いです。
パラダイムシフト:涙の「量」から「質」への転換

2019年、ドライアイの診断基準は革命的な変更となりました。
従来の「涙が少ない病気」という定義から、「涙液層の不安定性を主体とする多因子疾患」へと概念が大きく転換しました。
この変更の背景には、ドライアイの本質が単なる水分不足ではなく、涙液層全体の質的問題にあるという科学的知見の蓄積がありました。

新しいドライアイ診断の中核:涙液層破壊時間(BUT)
現在のドライアイ診断において最も重視されるのは、涙液層破壊時間(BUT: Break-Up Time)という指標です2。
BUTは瞬きをした後、涙の層に最初の破綻(ドライスポット)が生じるまでの時間を秒単位で測定するものです。
正常では10秒以上を保ちますが、ドライアイでは5秒以下に短縮します。
眼科の診察室ですぐできる検査です。
重要なのは、
BUT検査が「涙の安定性」を測定するため、シルマー検査のような「涙の量」を測定する検査とは異なる情報をもたらすことです。
蒸発亢進型ドライアイ:現代社会で急増する病態
眼科臨床では、ドライアイは「涙液減少型(ADDE: Aqueous Deficient Dry Eye)」と「蒸発亢進型(EDE: Evaporative Dry Eye)」の二つに大別されます3。
前者が従来の「涙が少ない」タイプであるのに対し、後者は「涙は十分あるが蒸発しやすい」タイプです。
蒸発亢進型ドライアイは現代社会で急増しており、その背景には長時間のデジタルデバイス使用によるまばたきの減少、空調環境での生活、コンタクトレンズの普及、高齢化などの要因があります。
これらは全て、涙の質を低下させるマイボーム腺機能不全(MGD)のリスク因子となります。
蒸発亢進型ドライアイの主な症状:
- 一般的なドライアイ症状: 乾燥感、異物感、目の疲労感、かすみ目、充血
- 特徴的な涙液異常症状: 涙があふれるのに乾く感覚、反射性流涙、瞬きによる一時的改善
- 時間・環境による変動: 朝より夕方に悪化、デジタルデバイス使用後の悪化、エアコン環境での症状増悪
- 眼瞼(まぶた)関連所見: まぶたの縁の発赤・腫れ、まつ毛の根元のフケ(コラレット)、眼脂の増加
- 日常生活への影響: 長時間のPC作業が困難になる、以前は問題なく使えていたコンタクトレンズが不快に感じる、目の不快感による作業効率の低下
涙の「量」だけでなく「質」にも着目した治療アプローチが重要です。
涙液層の3層構造:安定性の鍵を握る油層
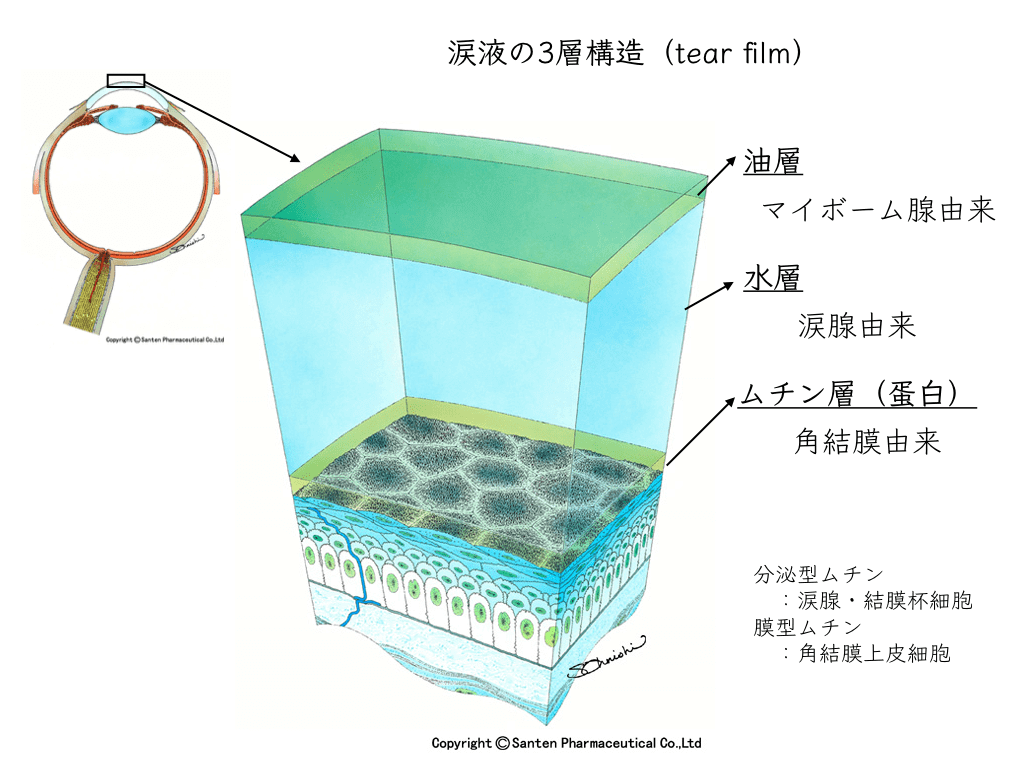
涙液層は油層(最外層)、水層(中間層)、ムチン層(最内層)の3層構造から成り、これらが適切にバランスを保つことで初めて健康な眼表面環境が維持されます。
油層は、マイボーム腺から分泌される脂質により形成され、涙の蒸発を防ぐバリアとして機能します。
マイボーム腺機能不全により油層が薄くなると、水層の蒸発が促進されます。その結果、たとえ涙の産生量が正常であっても、涙液層全体の安定性が損なわれ、様々なドライアイ症状が引き起こされます。
この現象は「乾かないドライアイ」とも呼ばれ、従来の概念を超えた新しいドライアイ理解の核心部分です。
マイボーム腺機能不全:「蒸発亢進型ドライアイ」の中核病態
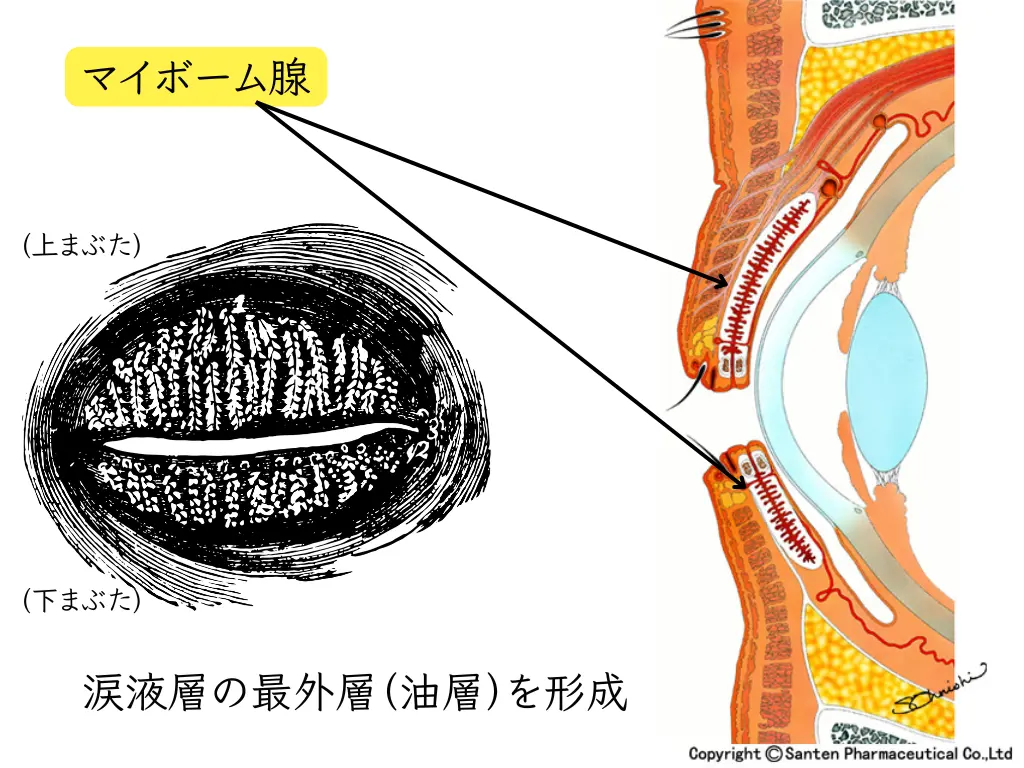
蒸発亢進型ドライアイの根底にあるのは、まぶたの縁に沿って並ぶマイボーム腺の機能障害です。
マイボーム腺機能不全(MGD: Meibomian Gland Dysfunction)は、現代の眼科学において最も重要な眼表面疾患の一つとして認識されるようになりました4。
マイボーム腺とは何か:涙の安定性を支える脂腺
マイボーム腺は上まぶたに約25個、下まぶたに約20個存在する特殊な脂腺で、マイバムと呼ばれる複雑な組成の脂質を分泌します。この脂質は、涙液層の最外層(油層)を形成し、次の重要な役割を果たしています:
- 涙の蒸発防止: 水層に蓋をするように覆い、涙の過剰蒸発を防ぎます
- 涙液層の安定化: 涙が眼表面に均一に広がるのを助けます
- 涙のあふれ防止: まぶたの縁を疎水性にし、涙があふれるのを防ぎます
- 眼表面の保護: 外部からの刺激物質の侵入を防ぐバリアとなります
健康なマイボーム腺からは、オリーブオイルのような透明な油分が分泌されます。
しかし、様々な要因によりマイボーム腺の機能が低下すると、分泌物の質が変化し、量も減少します。
その結果、涙液層の安定性が損なわれ、ドライアイの症状につながります。
マイボーム腺機能不全の進行メカニズム
MGDの病態は、次のような連鎖的なプロセスで進行します5:
- 閉塞性変化: マイボーム腺の開口部が角化物質や細菌バイオフィルム、まつ毛ダニなどにより閉塞します。これにより脂質の流出が阻害されます。
- 分泌物の変質: 閉塞により腺内に停滞した脂質は、徐々に粘稠度を増し、融点が上昇します。正常なマイバムの融点は約32-35℃ですが、MGDでは40℃以上に上昇することがあります(だいぶ温めないと溶けない)。
- 腺の萎縮: 長期的な閉塞と圧上昇は、最終的にマイボーム腺の萎縮を引き起こします。一度萎縮した腺は機能回復が困難であるため、早期発見・早期治療が極めて重要です。
- 悪循環の形成: 油層の不足は涙の蒸発を促進し、眼表面の炎症を誘発します。炎症はさらにマイボーム腺の機能を低下させるという悪循環が形成されます。
マイボーム腺機能不全の原因とリスク因子
マイボーム腺機能不全(MGD)の発症には様々な要因が関与していることが明らかになっています6。
加齢による変化
- 年齢の上昇に伴い、マイボーム腺の自然な萎縮が進行します7。年齢はマイボーム腺スコア異常の独立した予測因子であり、年齢が1歳上がるごとにリスクが約3%増加します(オッズ比 = 1.03/年)。
- 加齢に伴うホルモンバランスの変化も影響します。特に閉経後女性ではマイボーム腺機能低下のリスクが高まります10。
デジタルデバイスの使用
デジタルデバイスの使用とマイボーム腺機能不全(MGD)の関連は複数の研究で裏付けられています8:
- 1日2時間以上デジタルデバイスを使用する人は、そうでない人と比較してマイボーム腺の萎縮が有意に高いことが示されています。
- 子供の研究では、重度のマイボーム腺萎縮が見られる子供の86%が1日4時間以上の画面使用時間を持っていました。
- デジタルデバイスの使用中は瞬目回数が減少し(約70%減少)、涙の過度な蒸発を引き起こします。

コンタクトレンズの使用
コンタクトレンズ装用者とマイボーム腺機能不全(MGD)の関連は明確です9:
- マイボーム腺は涙液膜の脂質層を安定化させる重要な役割を担っています。
- コンタクトレンズ装着者ではマイボーム腺の減少が観察されています。
- マイボーム腺の減少は涙液膜の不安定性を助長し、ドライアイ症状の原因となります。
- 涙液膜の不安定性は異物感や乾燥感、違和感といった症状を引き起こします。
ホルモン要因
- 閉経後ホルモン療法を受けている女性では、マイボーム腺の喪失が高いことが見出されています(オッズ比 = 4.98)10。
- アンドロゲンレベルの低下もマイボーム腺機能不全と関連していると考えられています11。
その他のリスク因子
- 喫煙(オッズ比 = 2.05)10
- 抗アレルギー薬の使用(オッズ比 = 5.85)10
- β遮断薬や炭酸脱水酵素阻害薬などの薬剤 12
- まつ毛ダニ(デモデックス)の過剰増殖13
- 不適切なまぶたの衛生管理

環境要因

- 低湿度環境(特に空調の効いた部屋)14
- 風や汚染物質への暴露15
- 長時間のVDT(Visual Display Terminal)作業 16
これらの要因は単独で影響する場合もありますが、多くの場合、複数の要因が複合的に作用してマイボーム腺機能不全を引き起こします。適切な予防と管理には、これらのリスク因子を認識し、可能な限り制御することが重要です。
MGDを効果的に治療するには、これらの原因・危険因子を考慮した包括的アプローチが必要です。特に重要なのは、マイボーム腺の機能回復を促すための適切な眼瞼ケアです。
マイボーム腺機能不全(MGD):治療の実際
マイボーム腺機能不全(MGD)の治療において、眼瞼ケアは中心的役割を果たします。
特に「温め・溶かす・洗い流す」という三段階のアプローチが推奨されます12。
この方法を正しく実践することで、閉塞したマイボーム腺の機能回復を促し、涙液層の安定性を改善できると考えられます。
第一段階:「温める」—”温罨法” の科学
温罨法(おんあんぽう)は、凝固したマイボーム腺分泌物を軟化させるために不可欠な方法です。
マイボーム腺脂質の融点(約28-32℃)を超える温度で目を一定時間温めることで、脂質を流動化させます17。
温罨法の最適条件:
- 適切な温度: 40-45℃が最も効果的とされています。低すぎると脂質が十分に軟化せず、高すぎると眼表面に損傷を与える可能性があります。
- 持続時間: 最低5-10分間の継続的な加温が必要です。短時間では脂質の十分な軟化が得られません。
- 頻度: 急性期は1日2回、症状安定後は1日1回の実施が推奨されます。
効果的な温熱デバイスの選択:
- ビニール包装法: 温めたタオルをビニール袋に入れる方法は、熱の保持に優れています。タオルからの水分蒸発による急速な冷却を防ぎ、マイボーム腺脂質の再固化を防止します18。
- 蒸気式アイマスク: 「メグリズム」などの使い捨てタイプの蒸気アイマスクは、約40℃の温度を約10分間持続できます。手軽さと一定温度の維持が利点ですが、コストがかかる点が難点です。
- 電子レンジ加熱式アイマスク: 「あずきのチカラ」などのアイマスクは、電子レンジで加熱して繰り返し使用できます。温度管理に注意が必要ですが、経済的で環境にも優しい選択です。
- 専用加熱デバイス: 「LipiFlow」などの専門機器19は、精密な温度制御と同時マッサージ機能を備えていますが、一般家庭での使用は困難です。
第二段階:「溶かす・洗い流す」—アイシャンプーの役割

温熱療法で軟化させたマイボーム腺分泌物を、眼瞼専用クレンザーであるアイシャンプーを用いて洗浄することで、まぶたの清潔さを保ち、マイボーム腺開口部の閉塞を解消します20。
アイシャンプーの正しい使用法:
- 準備: 手を十分に洗浄し、アイシャンプーを5-6プッシュほど指先に取ります。
- 適用のタイミング: 温熱療法直後に行うことで、軟化した脂質の除去効率が高まります。
- 適切な洗浄技術: 目を閉じた状態で、まつ毛の根元を中心に、マイボーム腺開口部に沿って優しくマッサージします。強いこすり洗いは眼表面に損傷を与える可能性があるため避けます。
- 洗浄時間: 片目につき約30秒間かけて、丁寧に洗浄します。
- すすぎ: 清潔な水で十分にすすぎ、清潔なタオルで軽く拭き取ります。
アイシャンプーの選択基準:
臨床研究によれば、効果的なアイシャンプーは以下の特性を備えています20:
- 低刺激性(眼に入っても安全な成分構成)
- 適切な洗浄力(強すぎず、弱すぎない)
- マイボーム腺開口部の閉塞解消効果
- まつ毛ダニ(デモデックス)に対する制御効果
- 長期使用の安全性
マイボーム腺のケア:効果を最大化するために大事なこと
マイボーム腺ケアの効果を最大化するためには、以下の点に注意することが重要です21:
- 継続性: マイボーム腺機能の回復には、少なくとも6か月の継続的なケアが必要です。一時的な改善後も、維持療法として継続することで再発を防ぎます。
- 適切な圧力: まぶたへの圧力は「優しく、しかし効果的に」を心がけます。強すぎると眼表面を傷つけ、弱すぎると効果が不十分となります。
- 個別化アプローチ: マイボーム腺の状態は個人差が大きいため、症状や重症度に応じた頻度や方法の調整が必要です。特に萎縮が進行した重症例では、より頻回のケアが求められることがあります。
- 併用療法の検討: 重症例や慢性例では、眼瞼ケアだけでなく、適切な点眼薬(抗炎症薬など)との併用が効果的です。眼科専門医と相談の上、総合的な治療計画を立てることが望ましいでしょう。
マイボーム腺ケアは、一見シンプルな処置ですが、その科学的背景は複雑です。正しい方法で継続的に実施することで、多くの蒸発亢進型ドライアイ患者さんの症状改善が期待できます。特に初期から中等度のMGDでは、症状の進行を抑制し、健康なマイボーム腺機能の回復を促進する効果があります。
研究から見るアイシャンプーの効果と限界
マイボーム腺ケア、特に温罨法とアイシャンプーを組み合わせた眼瞼ケアの有効性については、近年複数の研究で検証が進められています。
眼瞼ケアの臨床的効果
複数の臨床研究では、適切な眼瞼ケアが以下のような効果をもたらすことが報告されています22:
- 涙液層安定性の改善: 継続的な眼瞼ケアにより、涙液層破壊時間(BUT)が延長し、涙液層の安定性が向上することが示されています。
- 自覚症状の改善: 多くの患者さんで、眼瞼ケアの継続によりドライアイの自覚症状スコアが改善することが報告されています。
- まつ毛ダニの制御: 適切な眼瞼ケアによってまつ毛ダニの密度が減少し、それに伴いマイボーム腺機能が改善する可能性が示唆されています。

効果と限界
眼瞼ケアの効果には個人差があり、以下のような点に注意する必要があります23:
- 効果の個人差: 研究によれば、マイボーム腺の状態(萎縮の程度など)によって効果が異なることが示唆されています。特に萎縮が進行した重症例では、標準的な眼瞼ケアだけでは十分な効果が得られないことがあります。
- 角膜染色スコアへの影響: いくつかの研究では、眼瞼ケアが一部の眼表面パラメーター(角膜染色スコアなど)に有意な改善をもたらさない場合があることも報告されています。
- 継続の重要性: 多くの研究が、効果を得るためには少なくとも6か月間の継続的なケアが必要であることを示しています。また、治療を中止すると症状が再発することが多いため、維持療法としての継続が推奨されます。
点眼薬との併用効果
ドライアイ治療において、眼瞼ケアと点眼薬治療を併用することで相乗効果が期待できます:
- 点眼薬単独療法と比較して、点眼薬と眼瞼ケアを併用した場合に症状改善率が高まることが報告されています。
- 欧米では免疫抑制薬のシクロスポリン点眼(Restasis®)や分子標的薬のリフィテグラスト(Xiidra®)などが使われます24が、日本には保険適用がありません。
実際は、フルオロメトロン(フルメトロン®)などの弱いステロイド点眼を使用します。
眼瞼ケアは、単純な処置ですが 科学的根拠に基づいた治療法です。
特に初期から中等度のマイボーム腺機能不全による蒸発亢進型ドライアイでは、適切な方法で継続することで症状の改善が期待できます。ただし、個々の状態に応じた治療計画の最適化と定期的な評価が重要です。
まとめ:「乾かないドライアイ」の新しい理解と対処法
ドライアイに対する理解は、この20年で革命的に変化しました。従来の「涙が少ない」という単純な概念から、「涙液層の安定性の問題」という複合的な理解へと進化しています。特に重要なのは以下の点です:
- 涙の量より質が重要: ドライアイ患者さんの約8割は涙の量が十分、あるいは過剰なほどあります。問題は涙の「量」ではなく「質」にあります。
- マイボーム腺ケアの中心的役割: まぶたの縁に並ぶマイボーム腺の機能を回復させることが、蒸発亢進型ドライアイ治療の基盤です。「温め・溶かす・洗い流す」という方法で油層を正常化し、涙の蒸発を防ぐことができます。
- 継続的ケアの重要性: マイボーム腺機能の回復には少なくとも6か月の継続的なケアが必要です。一時的な効果に満足せず、維持療法として続けることが症状改善の鍵となります。
- 早期介入の価値: マイボーム腺は一度萎縮すると再生が困難です。症状が軽度なうちから積極的な介入を行うことが、長期的な眼の健康維持において重要です。
- 生活習慣の見直し: デジタルデバイスの使用時間制限、室内湿度の管理、コンタクトレンズの適切な使用など、日常生活の中での予防的取り組みも効果的です。
蒸発亢進型ドライアイは現代社会で急増していますが、適切な理解と対処法があれば、多くの場合症状を効果的に管理できます。涙液層の不安定性を適切に評価し、マイボーム腺機能を改善するアプローチは、「涙があふれるのに目が乾く」という一見矛盾した症状に悩む方々に新たな希望をもたらします。
現在までの眼科医学の知見に基づいたケアを継続することで、多くの方が快適な視生活を取り戻せることを願います。
参考文献
- ドライアイ診療ガイドライン 日眼会誌. 123 (5): 489-592, 2019 http://journal.nichigan.or.jp/PastContent?mag=0&vol=123&year=2019&number=5
- Wu, Y., Wang, C., Wang, X., Mou, Y., Yuan, K., Huang, X., Jin, X., 2022. Advances in Dry Eye Disease Examination Techniques. Front. Med. 8. https://doi.org/10.3389/fmed.2021.826530
- Vidal-Rohr, M., Craig, J.P., Davies, L.N., Wolffsohn, J.S., 2024. Classification of dry eye disease subtypes. Cont Lens Anterior Eye 47, 102257. https://doi.org/10.1016/j.clae.2024.102257
- Chhadva, P., Goldhardt, R., Galor, A., 2017. Meibomian gland disease: the role of gland dysfunction in dry eye disease. Ophthalmology 124, S20–S26. https://doi.org/10.1016/j.ophtha.2017.05.031
- Du, Y.-L., Peng, X., Liu, Y., Wang, J.-S., Ye, Y.-F., Xu, K.-K., Qu, J.-Y., Chen, H., Xie, H.-T., Zhang, M.-C., 2023. Ductal Hyperkeratinization and Acinar Renewal Abnormality: New Concepts on Pathogenesis of Meibomian Gland Dysfunction. Curr Issues Mol Biol 45, 1889–1901. https://doi.org/10.3390/cimb45030122
- Kaur, K., Stokkermans, T.J., 2025. Meibomian Gland Disease, in: StatPearls. StatPearls Publishing, Treasure Island (FL).
- Moreno, I., Verma, S., Gesteira, T.F., Coulson-Thomas, V.J., 2023. Recent advances in age-related meibomian gland dysfunction (ARMGD). Ocul Surf 30, 298–306. https://doi.org/10.1016/j.jtos.2023.11.003
- Kocamiş, Ö., Temel, E., Aşikgarip, N., Örnek, K., 2021. Electronic Device Screen Time and Meibomian Gland Morphology in Children. J Ophthalmic Vis Res 16, 531–537. https://doi.org/10.18502/jovr.v16i4.9741
- Kojima, T., 2018. Contact Lens-Associated Dry Eye Disease: Recent Advances Worldwide and in Japan. Invest Ophthalmol Vis Sci 59, DES102–DES108. https://doi.org/10.1167/iovs.17-23685
- Machalińska, A., Zakrzewska, A., Safranow, K., Wiszniewska, B., Machaliński, B., 2016. Risk Factors and Symptoms of Meibomian Gland Loss in a Healthy Population. J Ophthalmol 2016, 7526120. https://doi.org/10.1155/2016/7526120
- Krenzer, K.L., Reza Dana, M., Ullman, M.D., Cermak, J.M., Tolls, D.B., Evans, J.E., Sullivan, D.A., 2000. Effect of Androgen Deficiency on the Human Meibomian Gland and Ocular Surface1. The Journal of Clinical Endocrinology & Metabolism 85, 4874–4882. https://doi.org/10.1210/jcem.85.12.7072
- Kaur, K., Stokkermans, T.J., 2024. Meibomian Gland Disease, in: StatPearls. StatPearls Publishing, Treasure Island (FL).
- Hao, Y., Zhang, X., Bao, J., Tian, L., Jie, Y., 2022. Demodex folliculorum Infestation in Meibomian Gland Dysfunction Related Dry Eye Patients. Front. Med. 9. https://doi.org/10.3389/fmed.2022.833778
- Song, M.-S., Lee, Y., Paik, H.J., Kim, D.H., 2023. A Comprehensive Analysis of the Influence of Temperature and Humidity on Dry Eye Disease. Korean J Ophthalmol 37, 501–509. https://doi.org/10.3341/kjo.2023.0077
- Hao, R., Wan, Y., Zhao, L., Liu, Y., Sun, M., Dong, J., Xu, Y., Wu, F., Wei, J., Xin, X., Luo, Z., Lv, S., Li, X., 2022. The effects of short-term and long-term air pollution exposure on meibomian gland dysfunction. Sci Rep 12, 6710. https://doi.org/10.1038/s41598-022-10527-y
- Bilgic, A.A., Kocabeyoglu, S., Dikmetas, O., Tan, C., Karakaya, J., Irkec, M., 2023. Influence of video display terminal use and meibomian gland dysfunction on the ocular surface and tear neuromediators. Int Ophthalmol 43, 1537–1544. https://doi.org/10.1007/s10792-022-02549-2
- Borchman, D., 2019. The Optimum Temperature for the Heat Therapy for Meibomian Gland Dysfunction. Ocul Surf 17, 360–364. https://doi.org/10.1016/j.jtos.2019.02.005
- Kwiecien, S.Y., Mathew, S., Howatson, G., McHugh, M.P., 2019. The effect of varying degrees of compression from elastic vs plastic wrap on quadriceps intramuscular temperature during wetted ice application. Scand J Med Sci Sports 29, 1109–1114. https://doi.org/10.1111/sms.13430
- Hu, J., Zhu, S., Liu, X., 2022. Efficacy and safety of a vectored thermal pulsation system (Lipiflow®) in the treatment of meibomian gland dysfunction: a systematic review and meta-analysis. Graefes Arch Clin Exp Ophthalmol 260, 25–39. https://doi.org/10.1007/s00417-021-05363-1
- Kobayashi, A., Ide, T., Fukumoto, T., Miki, E., Tsubota, K., Toda, I., 2016. Effects of a New Eyelid Shampoo on Lid Hygiene and Eyelash Length in Patients with Meibomian Gland Dysfunction: A Comparative Open Study. J Ophthalmol 2016, 4292570. https://doi.org/10.1155/2016/4292570
- Knop, E., Knop, N., Millar, T., Obata, H., Sullivan, D.A., 2011. The International Workshop on Meibomian Gland Dysfunction: Report of the Subcommittee on Anatomy, Physiology, and Pathophysiology of the Meibomian Gland. Investigative Ophthalmology & Visual Science 52, 1938–1978. https://doi.org/10.1167/iovs.10-6997c
- Alghamdi, Y.A., Camp, A., Feuer, W., Karp, C.L., Wellik, S., Galor, A., 2017. Compliance and Subjective Patient Responses to Eyelid Hygiene. Eye & Contact Lens 43, 213. https://doi.org/10.1097/ICL.0000000000000258
- Lam, P.Y., Shih, K.C., Fong, P.Y., Chan, T.C.Y., Ng, A.L.-K., Jhanji, V., Tong, L., 2020. A Review on Evidence-Based Treatments for Meibomian Gland Dysfunction. Eye Contact Lens 46, 3–16. https://doi.org/10.1097/ICL.0000000000000680
- Wei, Y., Asbell, P.A., 2014. The Core Mechanism of Dry Eye Disease (DED) Is Inflammation. Eye Contact Lens 40, 248–256. https://doi.org/10.1097/ICL.0000000000000042
![たける眼科 | 福岡市早良区 高取商店街[西新駅/藤崎駅]](https://takeru-eye.com/wp-content/uploads/2022/10/takeru_logo_for-WP-header.png)