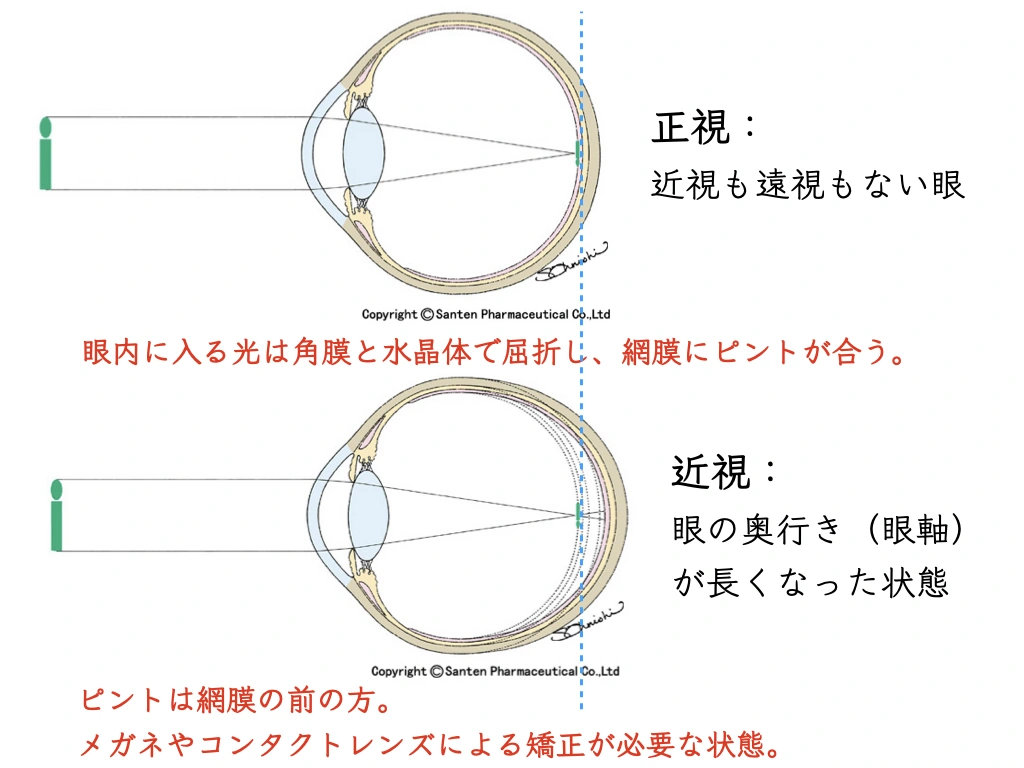
目の奥行き(眼軸長)が伸びることによって、近視が進行します(=”目が悪くなる”)1。
強度近視になり病的近視に移行してしまうと、
近視性黄斑変性・網膜剥離・緑内障など、重い視力障害をのこす病気になるリスクが高くなる2, 3。
そのため、予防治療がとても大事です4。
学問としての近視進行抑制(予防)がこの数年で大きく進歩し、眼科学の常識も変わりました。
生まれたときの眼軸長は短いです。
背が伸びるように、成長に伴ってだれでも眼軸長が伸びてきます。
さらに眼軸長が伸びる理由(=近視が進む、”目が悪くなる” 理由):
・目の中(網膜)にピントが合わない状態が続くと、眼軸長が伸びる生体反応が強くなる。
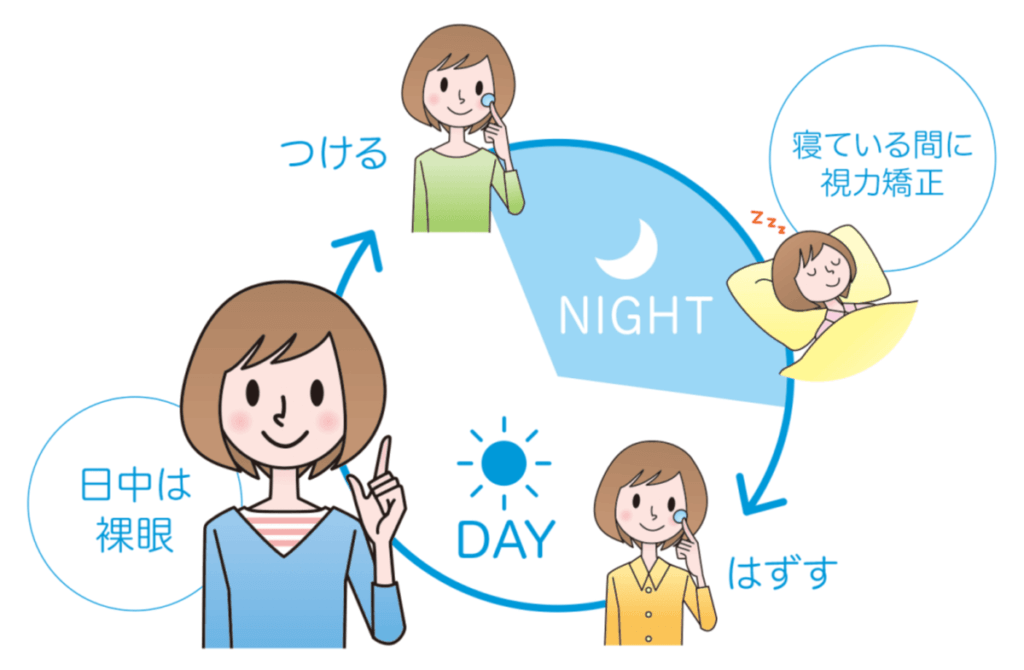
オルソケラトロジーとは:
特別なコンタクトレンズを就寝中に装用することで角膜の中心部の厚みを薄くする
→日中は網膜全体にピントが合うようになり、裸眼で過ごすことができる。
近視進行抑制に対して:
低用量アトロピン点眼/オルソケラトロジーの双方で、効果の統計学的な科学的証拠が多く発表されています5, 6。
オルソケラトロジーになぜ近視抑制効果があるのか、に対しての明確な答えは得られていません。
現在までに有力とされている理由:
○ 低用量アトロピン点眼:
「薬理学的な効果」7, 8
・ピント調節筋(毛様体筋)に作用し、調節を改善する。
・α2-アドレナリン受容体に作用し、目の壁(網膜・強膜)が伸びることに抵抗する。
○ オルソケラトロジー:
「光学的な効果」9, 10
・網膜の周辺部(全体)までピントが合うことによってぼやけを解消し、日中裸眼で過ごせるようになる
双方を組み合わせることで、近視進行抑制効果を高めることができます。
低用量アトロピン点眼/オルソケラトロジーの併用で、近視進行抑制効果が高くなる
以下の2つの相乗作用によって、
近視進行抑制(予防)の効果が大きくなると考えられます:
✔ 低用量アトロピン点眼により、わずかにひとみが大きくなる
✔ オルソケラトロジー治療により、日中は網膜全体にピントが合っている状態をつくりだす
2020年7月29日に、Scientific Reports誌(オンライン)で発表された知見:
オルソケラトロジーと低用量アトロピン併用によって、さらに近視進行抑制効果があった
研究結果のご紹介です。
上記併用治療での前向き対照研究(追跡)として、初めての知見です11。
[対象]
-1.00~-6.00Dの近視をもつ8-12歳の子ども、
オルソケラトロジー治療可能であった80名
オルソケラトロジー/低用量(0.01%)アトロピン 治療のグループ: 43名
オルソケラトロジー 単独治療のグループ: 37名
* オルソケラトロジー治療用レンズは、国内生産のブレスオーコレクトを使用。
* 各グループ治療前の年齢・性別・等価球面度数・眼軸長・角膜内皮細胞数・眼圧・裸眼視力の有意差無しを確認。
2つのグループにわけて2年間追跡(数名の脱落者有)、
6, 12, 18, 24か月の期間において眼軸長を計測し、近視進行抑制(予防)効果を解析。
[結果]
オルソケラトロジー/低用量アトロピン 治療のグループ
において、すべての期間で有意に近視進行抑制(予防)効果が確認された。
低用量アトロピン点眼とオルソケラトロジー:なぜ併用療法が効果があるか
2つの相乗効果:
1. 低用量アトロピンによりわずかに大きくなった瞳孔による薬理学的・光学的な効果
2. オルソケラトロジーの光学的な効果
低用量アトロピン点眼では、
明所での瞳孔径(ひとみの大きさ)が、わずかに大きくなります。
・0.91mm(ATOM2スタディー12)
・0.49mm(LAMPスタディー13)
そのため、低用量アトロピン点眼には
「薬理学的な効果」に加えて、
「光学的な効果」もある。
* 実際の診療では、こどもさんがまぶしくないかどうか に留意しています。
わずかに大きくなった瞳孔から入る光は、オルソケラトロジーによる「光学的効果」も高める14。
ことも、記載されています。


(参考)
1. Kimura, S., Hasebe, S., Miyata, M., Hamasaki, I., Ohtsuki, H., 2007. Axial Length Measurement Using Partial Coherence Interferometry in Myopic Children: Repeatability of the Measurement and Comparison with Refractive Components. Jpn J Ophthalmol 51, 105–110. https://doi.org/10.1007/s10384-006-0410-5
2. Asakuma, T., Yasuda, M., Ninomiya, T., Noda, Y., Arakawa, S., Hashimoto, S., Ohno-Matsui, K., Kiyohara, Y., Ishibashi, T., 2012. Prevalence and Risk Factors for Myopic Retinopathy in a Japanese Population: The Hisayama Study. Ophthalmology 119, 1760–1765. https://doi.org/10.1016/j.ophtha.2012.02.034
3. Flitcroft, D.I., 2012. The complex interactions of retinal, optical and environmental factors in myopia aetiology. Progress in Retinal and Eye Research 31, 622–660. https://doi.org/10.1016/j.preteyeres.2012.06.004
4. Morgan, I.G., Ohno-Matsui, K., Saw, S.-M., 2012. Myopia. The Lancet 379, 1739–1748. https://doi.org/10.1016/S0140-6736(12)60272-4
5. Chia, A., Lu, Q.-S., Tan, D., 2016. Five-Year Clinical Trial on Atropine for the Treatment of Myopia 2: Myopia Control with Atropine 0.01% Eyedrops. Ophthalmology 123, 391–399. https://doi.org/10.1016/j.ophtha.2015.07.004
6. Chia, A., Chua, W.-H., Wen, L., Fong, A., Goon, Y.Y., Tan, D., 2014. Atropine for the Treatment of Childhood Myopia: Changes after Stopping Atropine 0.01%, 0.1% and 0.5%. American Journal of Ophthalmology 157, 451-457.e1. https://doi.org/10.1016/j.ajo.2013.09.020
7. Carr, B.J., Nguyen, C.T., Stell, W.K., 2019. Alpha2-adrenoceptor agonists inhibit form-deprivation myopia in the chick. Clinical and Experimental Optometry 102, 418–425. https://doi.org/10.1111/cxo.12871
8. Gallego, P., Martínez‐García, C., Pérez‐Merino, P., Ibares‐Frías, L., Mayo‐Iscar, A., Merayo‐Lloves, J., 2012. Scleral changes induced by atropine in chicks as an experimental model of myopia. Ophthalmic and Physiological Optics 32, 478–484. https://doi.org/10.1111/j.1475-1313.2012.00940.x
9. Kang, P., Swarbrick, H., 2011. Peripheral Refraction in Myopic Children Wearing Orthokeratology and Gas-Permeable Lenses. Optometry and Vision Science 88, 476–482. https://doi.org/10.1097/OPX.0b013e31820f16fb
10. Smith, E.L., Hung, L.-F., Huang, J., 2009. Relative peripheral hyperopic defocus alters central refractive development in infant monkeys. Vision Research 49, 2386–2392. https://doi.org/10.1016/j.visres.2009.07.011
11. Kinoshita, N., Konno, Y., Hamada, N., Kanda, Y., Shimmura-Tomita, M., Kaburaki, T., Kakehashi, A., 2020. Efficacy of combined orthokeratology and 0.01% atropine solution for slowing axial elongation in children with myopia: a 2-year randomised trial. Sci Rep 10, 12750. https://doi.org/10.1038/s41598-020-69710-8
12. Chia, A., Chua, W.-H., Cheung, Y.-B., Wong, W.-L., Lingham, A., Fong, A., Tan, D., 2012. Atropine for the Treatment of Childhood Myopia: Safety and Efficacy of 0.5%, 0.1%, and 0.01% Doses (Atropine for the Treatment of Myopia 2). Ophthalmology 119, 347–354. https://doi.org/10.1016/j.ophtha.2011.07.031
13. Yam, J.C., Jiang, Y., Tang, S.M., Law, A.K.P., Chan, J.J., Wong, E., Ko, S.T., Young, A.L., Tham, C.C., Chen, L.J., Pang, C.P., 2019. Low-Concentration Atropine for Myopia Progression (LAMP) Study: A Randomized, Double-Blinded, Placebo-Controlled Trial of 0.05%, 0.025%, and 0.01% Atropine Eye Drops in Myopia Control. Ophthalmology 126, 113–124. https://doi.org/10.1016/j.ophtha.2018.05.029
14. Chen, Z., Niu, L., Xue, F., Qu, X., Zhou, Z., Zhou, X., Chu, R., 2012. Impact of Pupil Diameter on Axial Growth in Orthokeratology. Optometry and Vision Science 89, 1636–1640. https://doi.org/10.1097/OPX.0b013e31826c1831
![たける眼科 | 福岡市早良区 高取商店街[西新駅/藤崎駅]](https://takeru-eye.com/wp-content/uploads/2022/10/takeru_logo_for-WP-header.png)